El texto resaltado en ROJO se puede hacer de forma voluntaria o como ampliación si el profesor lo considera apropiado.
Antes de nada unas preguntillas:
- ¿Qué es Ciencia?¿qué no es?.
- ¿Crees que es importante en tu vida?¿es capaz de cambiar las vidas de las personas?.Pon algún ejemplo donde haya cambiado la vida de las personas.
- ¿Conoces algún científico?¿y que esté vivo actualmente?
- ¿Cómo se trabaja en la Ciencia?¿en qué consiste el método que sigue?
UD 1 El proceso científico
Factores de Conversión
Un factor de conversión es una operación matemática, para hacer cambios de unidades de la misma magnitud, o para calcular la equivalencia entre los múltiplos y submúltiplos de una determinada unidad de medida.
Errores comunes en la Física
¿Qué demonios hace concretamente un científico ?.En el siguiente artículo lo explican con un lenguaje comprensible-Vía Amazings.es
Un laboratorio es un sitio incómodo porque no se puede tocar nada sin guantes. Eso lo hace frío e interesante, pero realmente frío. Quizá por eso, con el tiempo, los científicos nos volvemos fríos con nuestros experimentos link al artículo de amazings.es o descarga el artículo debajo.
Sigue el enlace para teoría y ejercicios.
La divulgación científica (Vía - Cienciaenelbar):
¿Por qué debemos "creer" en los científicos?(Vía-TED-Ed), mejor pon subtítulos...
Como actividad dentro de esta unidad crearemos un TIMELINE sobre el "Método Científico" por medio de una Flipped Classroom. Podéis ver el siguiente videotutorial que explica cómo hacerlo (Vía: Juan García)
Juega clicando en las siguientes imágenes:
Realizaremos la PRÁCTICA "Comprobación de la dependencia del período de oscilación de un péndulo". En ella comprobaremos las siguientes hipótesis de partida:
- Depende de la masa del péndulo
- Depende de la longitud del péndulo
- Depende del ángulo que desplaces el péndulo de su posición de equilibrio
- Depende del color del péndulo
Para ello necesitaremos los siguientes materiales:
- Un hilo o sedal (pita en lenguaje santoñés)
- Un cronómetro
- Una cinta métrica
- Un bloque de plastilina
- Un transportador de ángulos
- Un par de clips
Calcularemos los distintos períodos de oscilación modificando una de las variables a estudiar y manteniendo todas las demás constantes (variables control). Con ellos lograremos dar con la dependencia de cada una de las variables estudiadas.
Realizaremos la PRÁCTICA "Comprobación de la dependencia de la velocidad de caída de un objeto con su masa". En ella comprobaremos las siguientes hipótesis de partida:
- En objeto más pesado cae más rápido
Para ello necesitaremos los siguientes materiales:
- Un estuche vacío
- Algo que pese y que quepa en el estuche (rotuladores....)
Con ellos lograremos dar con la dependencia de la variable estudiada.
En el laboratorio realizaremos la PRÁCTICA "Cálculo de la densidad del agua y del hierro". Para hacerlo deberás traer algunos tornillos de hierro o clavos.
Juego matemático MEDIR CON SISTEMA JUEGO 2
UD 2:La materia
Estableceremos la escala absoluta de temperaturas y la relacionaremos con la que se usa normalmente.
Llegaremos razonadamente a las leyes de los gases mediante varias experiencias utilizando el Método
Científico.
Estableceremos la ecuación de estado del GAS IDEAL.
Los gases y la teoría cinética en el siguiente enlace con teoría y ejercicios de autoevaluación donde se ve todo lo anterior.
El átomo:
Sustancias puras, mezclas....¿qué son?,¿cómo diferenciarlas?.
La clasificación de la materia en el siguiente enlace con teoría y ejercicios de autoevaluación.
Más en el siguiente:
Clasificación de la materia (Vía - Profes App):
Vídeo sobre elementos, compuestos y mezclas (vía- Ana María Prieto):
Realizaremos las PRÁCTICAS "Separación de componentes de una disolución":
- Separación del alcohol del vino: Informe científico sobre la práctica donde se recoja la problemática del consumo de alcohol en la sociedad
- Cálculo de la concentración de sal en el mar de la Bahía de Santoña: Informe científico comparándola con la de otros mares y exponiendo el efecto de la salinidad de las aguas en el clima planetario
- Separación de los componentes de la tinta de un rotulador
Juega en los siguientes enlaces:
En el siguiente enlace kahoot! sobre el tema...
UD 3:ESTRUCTURA DEL ÁTOMO. MODELOS ATÓMICOS
Toda la materia que podemos ver en el Universo, incluida la que forma los seres vivos, está constituida por átomos. Unos cuantos átomos, de todos los que existen en la naturaleza reúnen unas características que han posibilitado, mediante su combinación e interacción, formar innumerables compuestos que constituyen la esencia de la estructura y actividad de las diferentes formas de vida que hoy conocemos. Sabemos que el átomo es la unidad estructural que justifica la química de cualquier sistema, así pues, conocer la estructura del átomo se hace indispensable de cara a analizar tanto las estructuras como las innumerables reacciones químicas que constituyen los sistemas vivos y no vivos.
En el siguiente enlace puedes conocer la historia del átomo, entender la teoría atómica de Dalton, conocer los fenómenos eléctricos, identificar las partículas subatómicas, conocer los modelos atómicos de la materia ,entender el concepto de ion y distinguir entre catión, anión y átomo neutro y explicar el experimento de Rutherford.
Recuerda el tamaño relativo de los átomos, en el siguiente enlace puedes ver una animación interactiva para que te hagas una idea, bueno ya te la hiciste en 2ºESO.
El siguiente vídeo nos muestra cómo se ha ido suponiendo que son los átomos desde los griegos hasta la Teoría actual (vía- Profe en c@sa):
En el siguiente enlace podrás ver cómo se modelizan los átomos según la teoría moderna, aunque parafraseando a G.E.P. Box "todos los modelos están equivocados, pero algunos funcionan" .
Si pulsas en éste puedes entender lo que son los isótopos. En el siguiente enlace puedes hacer ejercicios sobre cálculo de masas promedio de isótopos naturales.
USO DE LOS ISÓTOPOS RADIACTIVOS
Hubo una tiempo en el que la radiactividad no estaba tan mal vista, visita el siguiente enlace.
El siguiente vídeo se ve el inicio de los estudios sobre la Radiactividad:
Podéis ver en el siguiente vídeo una reacción en cadena parecida a las necesarias para generar energía nuclear pero con pelotas de pin-pon y trampas de ratones (Vía- MistahGee1 Press Association):
El origen y uso de la energía nuclear:
El siguiente vídeo trata sobre la Energía Nuclear y sus consecuencias, haz un informe sobre la energía nuclear, usos y peligros con un comentario personal sobre el tema:
Los residuos radiactivos se pueden clasificar en :
- Residuos de muy baja, baja y media actividad tienen concentraciones bajas de material radiactivo, debido fundamentalmente a la presencia de radionucleidos de periodo de semidesintegración de vida media inferior a 30 años, y un contenido en radionucleidos de periodo largo muy bajo y limitado. Proceden del funcionamiento normal de las instalaciones radiactivas y de la operación de las centrales nucleares, así como de la medicina.
- Residuos de alta actividad procedentes de Centrales Nucleares generalmente.
En la siguiente infografía podemos observar uno de los destinos de los Residuos de baja y media actividad, el ATC de El Cabril.
En los siguientes enlaces puedes aprender algo sobre la radiactividad, la fisión nuclear, aplicaciones de los radioisótopos y gestión de residuos radiactivos,o emergencias radiactivas, en los mismos enlaces vienen otros para ampliar información así como vídeos del CSN.
Enlace a la teoría sobre la molécula del agua, tan importante para a vida.
Kahoot! sobre el tema en el siguiente link
UD 4: Los Átomos y el Sistema Periódico.Elementos y compuestos
Los átomos y sus combinaciones (Vía - R.A. Chávez):
Vas a tener que aprenderte la TP , pero puedes hacerlo jugando mediante la siguiente TP vacía. Varios de los alumnos han conseguido una puntuación perfecta en el juego, sin ningún fallo al colocarlos....
En el siguiente enlace tienes información sobre elementos y compuestos.Tienes a tu disposición debajo una Tabla Periódica Interactiva bastante completa. Pulsa sobre ella.
En este otro enlace podemos ver la evolución de las agrupaciones de los elementos desde el principio hasta la actual ordenación :
¿Quieres aprender la Tabla Periódica de forma rápida?(Vía-Amigos de la Química). También puedes buscar tú la regla mnemotécnica...
Este vídeo es un fragmento del episodio 9 de COSMOS original, en el que el gran Carl Sagan explica el origen de los elementos químicos, la ordenación de la Tabla Periódica y la estabilidad de los átomos. La explicación la da desde el Laboratorio Cavendish Los Laboratorios Cavendish han tenido una importante influencia en el desarrollo de la Biología moderna. Aunque la labor experimental basada en la aplicación de la cristalografía de rayos X al estudio de la estructura de biomoléculas fuera desarrollada por Rosalind Franklin en el King's College de Londres, fueron Francis Crick y Watson quienes, mientras trabajaban en el laboratorio Cavendish, se hicieron con la información obtenida por Franklin y anunciaron antes que ella la estructura de doble hélice de ADN. Gracias a su trabajo les fue otorgado el premio Nobel de Medicina en 1962.
¿Tienes curiosidad por saber cuántos de ellos se han descubierto en España? Echa un vistazo a la siguiente tabla , ahí te darás cuenta de nuestra importancia en el mundo científico en los últimos 100 años...
Puedes construir átomos en el siguiente enlace.
Para memorizar el orden de llenado de los orbitales tenemos el siguiente diagrama:



Vale, muchos elementos se unen formando moléculas pero o¿mediante qué tipos de enlaces?. Echa un vistazo al siguiente vídeo (Vía- Amigos de la química).
Usaremos la AR con el programa Elements 4D que tenéis que instalar en el móvil. con el podremos ver cómo son los distintos elementos, cómo se unen y qué resulta.Puedes descargar el manual a continuación.

Puedes descargar los cubos e imprimirlos también:
Curiosos los nombres de los elementos ¿eh?,si quieres conocer su procedencia pincha el siguiente link

Colección de fotos sobre el Reciclaje de Medicamentos, dentro del Plan de Sostenibilidad del Centro:
Para jugar haz clic en las siguientes imágenes:
Anexo: Nomenclatura y formulación inorgánica
No seguiremos ese libro en clase , sino el siguiente Manual de Formulación inorgánica y orgánica de 4ºESO y Bachillerato. Nomenclatura y Formulación Inorgánica que está más explicado y es más sencillo, solo veremos compuestos binarios , pero como ampliación se puede ver los ternarios aunque si no se verá en 4ºESO. A continuación en un libro digital descarga e imprime para traerlo a clase o tráelo en formato digital:
En el siguiente enlace tenemos información interactiva sobre conceptos de átomos ( aniones, cationes, isótopos...) y en éste otro enlace sobre nomenclatura inorgánica.
El número de oxidación se define como la carga eléctrica “formal” (puede que no sea real) que se asigna a un átomo de un elemento en un compuesto, y por lo tanto el número de oxidación podrá ser un número positivo o negativo,así el número o estado de oxidación es la carga eléctrica que un átomo "parece" tener cuando forma parte de un compuesto. Recordad que, en general, el número de oxidación no representa la carga eléctrica real de un átomo en un compuesto, ya que todos los compuestos no están formados por iones. Por ejemplo, en el monóxido de nitrógeno (NO) y en el monóxido de calcio (CaO) el número de oxidación del oxígeno es –2 en ambos compuestos; pero en el NO no existe una carga real de –2 en el átomo de oxígeno, ni de +2 en el de nitrógeno, pues se trata de un compuesto covalente (débilmente polar). En cambio, en CaO sí que hay cargas reales, porque es un compuesto iónico.
La definición de valencia de un elemento en un compuesto (más extendida) es el número de átomos de hidrógeno que se combinan con un átomo de dicho elemento, y por lo tanto la valencia es siempre un número natural. También es el número de electrones perdidos o ganados por el elemento (valencia iónica) o el número de electrones compartidos (valencia covalente) por el elemento en un compuesto.
El concepto de valencia resulta útil en la formulación de compuestos binarios, mientras que el número de oxidación lo es en compuestos de tres o más elementos.
Para acabar de entender la diferencia entre número de oxidación y valencia, un ejemplo con cuatro compuestos de carbono:
CH4 -> C: -4, H: +1
CH3Cl -> C: -2, H: +1, Cl -1
CH2Cl2 -> C: 0, H: +1, Cl -1
CCl4 -> C: +4, Cl -1
En todos ellos el carbono presenta invariablemente su valencia de 4 (en las moléculas de estos cuatro compuestos, el átomo de carbono se combina con otros cuatro átomos). Sin embargo, el número de oxidación del carbono es distinto en cada compuesto (como se indica a la derecha de cada compuesto). En todos ellos, el hidrógeno tiene estado de oxidación +1, y el cloro -1, por lo que para que la molécula sea neutra, el carbono tiene distintos estados de oxidación (-4, -2, 0 y +2respectivamente)
(Vía -Aida Ivars Rodríguez)
Más información sobre ello en el siguiente enlace.
El Proyecto Ulloa del Ministerio de Educación nos proporciona un material interactivo con más teoría y ejercicios:
También te puedes descargar el archivo siguiente con un resumen de Nomenclatura y Formulación inorgánica que se usaba hasta 2005, con lo que sólo tienes que ver la tradicional que se sigue usando hoy en día, y ten en cuenta que toda la documentación generada antes de 2005 usaba la nomenclatura de Stock o la sistemática o la tradicional que ya debería estar en desuso:
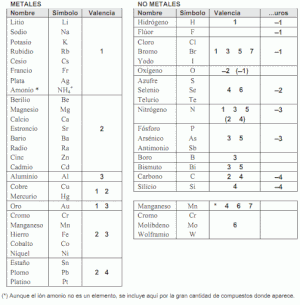
Tabla de Valencias para formular :

Secuencia de electronegatividades (no es exactamente así pero para simplificar todo se puede tomar esa secuencia). El flúor es una excepción, pues es el único elemento más electronegativo que el oxígeno, y solo puede actuar con número de oxidación negativo (–I), por lo que en combinación con él, el oxígeno será el que actúa con número de oxidación positivo (II). Es por ello que, tradicionalmente, el óxido de flúor ha sido el único en el que el orden de los elementos en la fórmula se invertía, representándose como OF2. Y digo tradicionalmente porque con las últimas recomendaciones de la IUPAC (de 2005) la situación ha cambiado. Anteriormente, el oxígeno mantenía un estatus especial, que le permitía ir siempre en último lugar en la fórmula de cualquier óxido (salvo en el caso del flúor, como se ha explicado). Actualmente, la IUPAC retira esta consideración al oxígeno, lo que implica que su posición en la fórmula debe seguir los mismos criterios que el resto de elementos, en función de su posición en la tabla periódica. No te lo perdonaré jamás, IUPAC !!!!! Si ya la química es liosa para lo alumnos, vienen y lo complican más. Para más información sl siguiente enlace.
A continuación una serie de enlaces donde realizar ejercicios online para practicar nomenclatura y formulación inorgánica vista en 4ºESO (Vía- Alonsofórmula.com):
Puedes ir al curso de química en el siguiente de LIDIA CON LA QUÍMICA ,gran Blog del profesor burgalés Enrique Castaños.
A continuación una serie de videos explicativos de la Química Inorgánica ,es lo mismo que vemos en clase, pero los podéis ver tantas veces como queráis....es gratis.
A continuación unos enlaces sobre varios temas:
UD 5:Las reacciones químicas: Cambios químicos y sus repercusiones
Primeramente te iniciarás en la estequiometría química.
Vídeo sobre cómo calcular los coeficientes estequimétricos (Vía-PuntajeNacional Chile)
Conocerás algunas reacciones químicas de interés.
Un vez que domines eso, reconocerás los cambios químicos y los diferenciarás de los cambios físicos.Conocerás qué es una reacción química y sus componentes, así como las
características y leyes de las reacciones químicas: ley de conservación de la masa, energía y velocidad de reacción.
Ajustarás las ecuaciones químicas y escribirás correctamente la notación de las mismas.
Interpretarás el funcionamiento, a nivel microscópico, de las reacciones químicas.
Reconocerás reacciones químicas que se producen continuamente en la naturaleza y serás capaz de interpretar el significado de las reacciones químicas.
Valorarás la importancia que tienen las reacciones químicas y por tanto la
necesidad de su estudio y conocimiento.
Vídeo para aprender a pasar de gramos a moles y estos a moléculas o átomos y viceversa (Vía-Amigos de la Química)
Vídeo sobre ejercicios de cálculo de gramos, volúmenes y moles (Vía-Amigos de la Química)
UD 6:La energía
Echa un vistazo al apartado Anexo en Tecnologías de 3ºESO de este mismo sitio donde puedes ver las fuentes de energía y las principales formas de generar energía eléctrica.
Realizarás en esta unidad un TRABAJO sobre la cocida como "Ruta de la M**** de Santoña" o sobre el Fracking, debatiremos sobre ambos temas en clase.
 Jose Tezanos de la Herranz
Jose Tezanos de la Herranz